ธาตุอีกกลุ่มหนึ่งในตารางธาตุซึ่งมีสมบัติแตกต่างจากธาตุที่เคยศึกษามาแล้วคือ สามารถแผ่รังสี แล้วกลายเป็นอะตอมของธาตุใหม่ได้นักเรียนคิดว่าการเปลี่ยนแปลงเหล่านี้เกิดขึ้นได้อย่างไร
ในปีพ.ศ. 2439 อองตวน อองรีแบ็กเกอเรล (Antoine Henri Becquerel) นักวิทยาศาสตร์ ชาวฝรั่งเศสพบว่า เมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำ ไว้กับสารประกอบของยูเรเนียม แผ่น ฟิล์มจะมีลักษณะเหมือนถูกแสง และเมื่อทำ การทดลองกับสารประกอบของยูเรเนียมชนิดอื่น ๆ ก็ได้ ผลเช่นเดียวกัน จึงสรุปว่าน่าจะมีรังสีแผ่ออกมาจากธาตุยูเรเนียม
ต่อมาปีแอร์กูรีและมารีกูรี(Pierre Curie และ Marie Curie) ได้ค้นพบว่า ธาตุพอโลเนียม เรเดียม และทอเรียม ก็สามารถแผ่รังสีได้เช่นเดียวกัน ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง เรียกว่า กัมมันตภาพรังสี (radioactivity) ซึ่งเป็นการเปลี่ยนแปลงภายในนิวเคลียสของไอโซโทปที่ ไม่เสถียร และไอโซโทปของธาตุที่สามารถแผ่รังสีได้เองอย่างต่อเนื่องเรียกว่าไอโซโทปกัมมันตรังสี (radioactive isotope) หรือสารกัมมันตรังสี(radioactive substance) เช่น carbon-14 (C-14) สำ หรับธาตุที่ทุกไอโซโทปเป็นไอโซโทปกัมมันตรังสีจะเรียกธาตุที่มีสมบัติเช่นนี้ว่า ธาตุกัมมันตรังสี (radioactive element) ธาตุกัมมันตรังสีส่วนใหญ่มีเลขอะตอมสูงกว่า 83 เช่น U-238 U-235 Th-232 Rn-222 ในธรรมชาติพบธาตุกัมมันตรังสีหลายชนิด นอกจากนี้นักวิทยาศาสตร์ยังสังเคราะห์ธาตุ กัมมันตรังสีขึ้นเพื่อใช้ประโยชน์ในด้านต่าง ๆ
2.6.1 การเกิดกัมมันตภาพรังสี
กัมมันตภาพรังสีเป็นปรากฏการณ์ที่เกิดกับไอโซโทปกัมมันตรังสีเพราะนิวเคลียสมีพลังงาน สูงมากและไม่เสถียร จึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสี จากการศึกษาของ นักวิทยาศาสตร์แสดงให้เห็นว่า รังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสีอาจเป็นรังสีแอลฟา (alpha ray) รังสีบีตา (beta ray) หรือแกมมา (gamma ray) ดังรูป 2.31
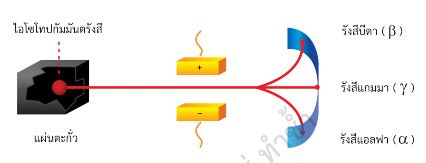 |
| รูป 2.31 การแผ่รังสีของไอโซโทปกัมมันตรังสีผ่านสนามไฟฟ้า |
รังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสี เช่น รังสีแอลฟา บีตา แกมมา มีสมบัติเป็นอย่างไร ศึกษาได้จากตาราง 2.13
รังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสีนอกจากรังสีแอลฟา บีตา แกมมา แล้วยังมีรังสีชนิดอื่น ๆ เช่น โพซิตรอน (β+ ) สัญลักษณ์คือ +₁⁰e โปรตอน (p) สัญลักษณ์คือ ¹₁H
ดิวเทอรอน (D) สัญลักษณ์คือ ²₁H ทริทอน (T) สัญลักษณ์คือ ³₁H นิวตรอน (n) สัญลักษณ์คือ ₀¹n
2.6.2 การสลายตัวของไอโซโทปกัมมันตรังสี
จากการศึกษาไอโซโทปของธาตุจำ นวนมากทำ ให้ได้ข้อสังเกตว่า ไอโซโทปของนิวเคลียสที่มี อัตราส่วนระหว่างจำ นวนนิวตรอนต่อจำ นวนโปรตอนไม่เหมาะสมคือนิวเคลียสที่มีจำ นวนนิวตรอน แตกต่างจากจำ นวนโปรตอนมากเกินไปจะไม่เสถียร จึงเกิดการเปลี่ยนแปลงภายในนิวเคลียสโดย การแผ่รังสี(radiation) ออกมาแล้วเกิดเป็นนิวเคลียสของธาตุใหม่ที่เสถียรกว่า ดังตัวอย่างต่อไปนี้
การแผ่รังสีแอลฟา ส่วนใหญ่เกิดกับนิวเคลียสที่มีเลขอะตอมสูงกว่า 83 และมีจำ นวนนิวตรอน ต่อโปรตอนในสัดส่วนที่ไม่เหมาะสม เมื่อปล่อยรังสีแอลฟาออกมาจะกลายเป็นนิวเคลียสของธาตุใหม่ที่ เสถียรซึ่งมีเลขอะตอมลดลง 2 และเลขมวลลดลง 4 ดังตัวอย่าง
ชนิดของรังสีที่ไอโซโทปกัมมันตรังสีหรือธาตุกัมมันตรังสีปลดปล่อยออกมา สามารถพิจารณา ได้จากกราฟในรูป 2.32
 |
| รูป 2.32 เขตเสถียรภาพของไอโซโทปของธาตุและชนิดของรังสีที่แผ่นอกเขตเสถียรภาพ |
นิวเคลียสของไอโซโทปกัมมันตรังสีสามารถสลายตัวและแผ่รังสีได้ตลอดเวลาโดยไม่ขึ้นกับ อุณหภูมิหรือความดัน การสลายตัวและแผ่รังสีของไอโซโทปกัมมันตรังสีจะเป็นสัดส่วนโดยตรงกับ จำ นวนอนุภาคในนิวเคลียสกัมมันตรังสีนั้น
2.6.3 อันตรายจากไอโซโทปกัมมันตรังสี
กิจวัตรต่าง ๆ ในชีวิตประจำ วันทั้งการรับประทานอาหาร การดื่มน้ำ การหายใจ ล้วนมีโอกาส ที่มนุษย์จะได้รับรังสีจากไอโซโทปกัมมันตรังสีเช่น K-40 C-14 Ra-226 เข้าสู่ร่างกาย นอกจากนี้ ยังได้รับรังสีคอสมิก (cosmic ray) ซึ่งส่วนใหญ่มาจากอวกาศ รังสีต่าง ๆ เหล่านี้มีแหล่งกำ เนิดจาก ธรรมชาตินอกจากนี้บางคนยังได้รับรังสีที่มนุษย์สร้างขึ้นมา เช่น รังสีจากเครื่องเอกซเรย์รังสีจาก โรงไฟฟ้านิวเคลียร์
 |
| รูป 2.33 ปริมาณรังสีที่ได้รับในแต่ละวันโดยประมาณ |
แม้มนุษย์จะได้รับรังสีจากกิจวัตรประจำ วัน แต่การได้รับรังสีจากธรรมชาติหรือจากที่มนุษย์ สร้างขึ้นในปริมาณเพียงเล็กน้อย โดยน้อยกว่า 100 มิลลิซีเวิร์ตพบว่า เซลล์เนื้อเยื่อสามารถฟื้นตัวได้ แต่การได้รับรังสีมากกว่า 100 มิลลิซีเวิร์ต ทำ ให้ เกิดความเสี่ยงต่อสุขภาพ เช่น คลื่นไส้ อาเจียน ปวดศีรษะ เป็นมะเร็ง โรคทางพันธุกรรม ต้อแก้วตา การได้รับรังสีปริมาณมากทั่วร่างกายในเวลาสั้น ๆ สามารถทำ ให้เสียชีวิตได้
สำหรับหน่วยงานที่ทำ งานเกี่ยวกับรังสีจะต้องแสดงสัญลักษณ์รังสี(radiation symbol) ลงบน ฉลากของภาชนะหรือเครื่องมือรวมทั้งบริเวณใกล้เคียง เพื่อให้ผู้พบเห็นได้ระมัดระวัง สัญลักษณ์รังสี ใช้เป็นมาตรฐานจะเป็นรูปใบพัด 3 แฉก มีสีม่วงอ่อน ม่วงเข้ม หรือสีดำ บนพื้นสีเหลือง ดังรูป 2.34
 |
| รูป 2.34 สัญลักษณ์รังสี |
เนื่องจากสัญลักษณ์รังสีดังรูป 2.34 อาจสื่อความหมายไม่ชัดเจนหรือบุคคลที่ไม่เกี่ยวข้องอาจ ไม่เข้าใจความหมาย ดังนั้นทบวงปรมาณูระหว่างประเทศ (International Atomic Energy Agency หรือ IAEA) และองค์กรระหว่างประเทศว่าด้วยมาตรฐาน (International Organization for Standardization หรือ ISO) ได้ออกแบบสัญลักษณ์ใหม่เป็นรูปคลื่นของรังสีกะโหลกไขว้และคนกำ ลังวิ่ง ดังรูป 2.35 โดยมีการประกาศใช้เมื่อวันที่ 15 กุมภาพันธ์ 2550
 |
| รูป 2.35 สัญลักษณ์รังสีแบบใหม |
2.6.4 ครึ่งชีวิตของไอโซโทปกัมมันตรังสี
ไอโซโทปกัมมันตรังสีจะสลายตัวให้รังสีชนิดใดชนิดหนึ่งออกมาได้เองตลอดเวลา ไอโซโทป กัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน อัตราการสลายตัวของไอโซโทปกัมมันตรังสี จะบอกเป็น ครึ่งชีวิต (half life) ใช้สัญลักษณ์t₁/₂ โดยหมายถึง ระยะเวลาที่นิวเคลียสของไอโซโทป กัมมันตรังสีสลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม ไอโซโทปกัมมันตรังสีของธาตุชนิดหนึ่ง ๆ จะมี ครึ่งชีวิตคงเดิมไม่ว่าจะอยู่ในรูปของธาตุหรือเกิดเป็นสารประกอบ เช่น Na-24 มีครึ่งชีวิต 15 ชั่วโมง หมายความว่าถ้าเริ่มต้นมีNa-24 ปริมาณ 10 กรัม นิวเคลียสนี้จะสลายตัวให้รังสีออกมาจน กระทั่งเวลาผ่านไปครบ 15 ชั่วโมง จะมีNa-24 เหลืออยู่ 5 กรัม และเมื่อเวลาผ่านไปอีก 15 ชั่วโมง จะมีNa-24 เหลืออยู่ 2.5 กรัม นั่นคือเวลาผ่านไปทุก ๆ 15 ชั่วโมง Na-24 จะสลายตัวไปเหลือเพียง ครึ่งหนึ่งของปริมาณเดิม เขียนแสดงได้ดังรูป 2.36
 |
| รูป 2.36 แสดงปริมาณของ Na-24 ที่ลดลงครึ่งหนึ่งทุก ๆ 15 ชั่วโมง |
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทปและสามารถใช้เปรียบเทียบอัตราการสลายตัว ของไอโซโทปกัมมันตรังสีแต่ละชนิดได้ ตัวอย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด แสดงดัง ตาราง 2.14
ระยะเวลาที่แสดงถึงครึ่งชีวิตของไอโซโทปกัมมันตรังสีสามารถนำ ไปใช้คำ นวณหาปริมาณของ ไอโซโทปกัมมันตรังสีในระยะเวลาต่าง ๆ กันได้ดังตัวอย่างต่อไปนี้
2.6.5 ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของไอโซโทปกัมมันตรังสีอาจเกิดจากการ แตกตัวของนิวเคลียสของอะตอมที่มีขนาดใหญ่ หรือเกิดจากการรวมตัวของนิวเคลียสของอะตอมที่มี ขนาดเล็กแล้วได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่ รวมทั้งมีพลังงานเกี่ยวข้องกับปฏิกิริยาเป็น จำนวนมหาศาล ซึ่งสามารถนำ มาใช้ประโยชน์ได้
ในปีพ.ศ. 2482 นักวิทยาศาสตร์ได้ค้นพบว่าเมื่อยิงอนุภาคนิวตรอนไปยังนิวเคลียสของ U-235 นิวเคลียสจะแตกออกเป็นนิวเคลียสของธาตุที่เบากว่า เช่น
กระบวนการที่นิวเคลียสของไอโซโทปของธาตุหนักบางชนิด แตกออกเป็นไอโซโทปของธาตุที่ เบากว่าดังตัวอย่างที่กล่าวมาแล้วเรียกว่า ฟิชชัน (fission) ไอโซโทปของธาตุอื่นที่สามารถเกิดฟิชชัน ได้เช่น U-238 หรือ Pu-239 การเกิดฟิชชันแต่ละครั้งจะคายพลังงานออกมาจำ นวนมากและได้ ไอโซโทปกัมมันตรังสีหลายชนิด จึงถือได้ว่าฟิชชันเป็นวิธีผลิตไอโซโทปกัมมันตรังสีที่สำ คัญ นอกจาก นี้ฟิชชันยังได้นิวตรอนเกิดขึ้นด้วย ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่น ๆ จะเกิด ฟิชชันต่อ เนื่องไปเรื่อย ๆ เรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่ (chain reaction) ดังรูป 2.37
 |
| รูป 2.36 แสดงปริมาณของ Na-24 ที่ลดลงครึ่งหนึ่งทุก ๆ 15 ชั่วโมง |
ฟิชชันที่เกิดขึ้นภายใต้ภาวะที่เหมาะสม จะได้จำ นวนนิวตรอนเพิ่มขึ้นอย่างรวดเร็ว ทำ ให้ฟิชชัน ดำ เนินไปอย่างรวดเร็วและปล่อยพลังงานออกมาจำ นวนมหาศาล ถ้าไม่สามารถควบคุมปฏิกิริยาได้ อาจเกิดการระเบิดอย่างรุนแรง หลักการของการเกิดปฏิกิริยาลูกโซ่ได้นำ มาใช้ในการทำ ระเบิดปรมาณู การควบคุมฟิชชันทำ ได้หลายวิธี เช่น ควบคุมมวลของสารตั้งต้นให้น้อยลงเพื่อให้จำ นวนนิวตรอนที่ เกิดขึ้นมีไม่เพียงพอที่จะทำ ให้เกิดปฏิกิริยาลูกโซ่ได้หรือใช้โลหะแคดเมียมและโบรอนจับนิวตรอน บางส่วนไว้เพื่อลดจำ นวนนิวตรอนที่เกิดขึ้น ปัจจุบันนักวิทยาศาสตร์นำ ฟิชชันมาใช้ประโยชน์อย่าง กว้างขวาง เช่น ใช้ผลิตไอโซโทปกัมมันตรังสีในเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการเกษตร การแพทย์ และอุตสาหกรรม ใช้ผลิตกระแสไฟฟ้าในโรงไฟฟ้าปรมาณู
ในกรณีที่นิวเคลียสของธาตุเบาสองชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่า เดิมและให้พลังงานปริมาณมากดังตัวอย่าง
กระบวนการนี้เรียกว่า ฟิวชัน (fusion) ปฏิกิริยาทั้งสองนี้เป็นปฏิกิริยาเดียวกับที่เกิดขึ้นบน ดวงอาทิตย์ การเกิดฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมาก เพื่อเอาชนะแรงผลักระหว่างนิวเคลียส ที่จะเข้ารวมกัน ซึ่งประมาณกันว่าจะต้องมีอุณหภูมิสูงถึงหลายล้านองศาเซลเซียส พลังงานมหาศาลนี้ อาจได้จากฟิชชันซึ่งเปรียบเสมือนเป็นชนวนที่ทำ ให้เกิดฟิวชัน ถ้าพลังงานที่ปล่อยออกมาจากฟิวชัน เกิดขึ้นอย่างรวดเร็วจะเกิดการระเบิดอย่างรุนแรง แต่ถ้าควบคุมให้มีการปล่อยพลังงานออกมาอย่าง ช้า ๆ และต่อเนื่องจะให้พลังงานมหาศาลที่เป็นประโยชน์ต่อมนุษย์ ฟิวชันมีข้อได้เปรียบกว่าฟิชชัน หลายประการกล่าวคือ คายพลังงานออกมามาก สารตั้งต้นของฟิวชันหาได้ง่ายและมีปริมาณมาก นอกจากนี้ผลิตภัณฑ์ที่เกิดจากฟิวชันเป็นธาตุกัมมันตรังสีที่มีครึ่งชีวิตสั้นและมีอันตรายน้อยกว่า ผลิตภัณฑ์จากฟิชชัน
แม้จะมีการค้นพบกระบวนการฟิวชันมานานแต่การนำ มาใช้อย่างเป็นรูปธรรมเป็นไปได้ยาก เพราะการเกิดฟิวชันต้องใช้อุณหภูมิสูงมาก ซึ่งที่สภาวะนี้สารจะเปลี่ยนรูปเป็นพลาสมา (plasma) ซึ่งไม่เสถียร ดังนั้นการควบคุมกระบวนการฟิวชันให้เกิดขึ้นอย่างต่อเนื่องเป็นไปได้ยากมาก
ตัวอย่างของการพยายามนำ ความรู้เรื่องฟิวชันมาใช้ประโยชน์ เช่น การสร้างโทคาแมค (tokamak) ขนาดใหญ่ภายใต้โครงการผลิตเครื่องปฏิกรณ์นิวเคลียร์ฟิวชันซึ่งเป็นความร่วมมือกันในระดับ นานาชาติมีสมาชิกหลักคือ สหรัฐอเมริกา ยุโรป รัสเซีย จีน ญี่ปุ่น และ เกาหลีใต้โครงการนี้มี วัตถุประสงค์เพื่อสร้างต้นแบบของโรงผลิตพลังงานไฟฟ้าโดยใช้ฟิวชัน
2.6.6 เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
สารกัมมันตรังสีแต่ละชนิดมีครึ่งชีวิตไม่เท่ากันและแผ่รังสีได้แตกต่างกัน การนำ สารกัมมันตรังสี มาใช้ประโยชน์จึงแตกต่างกันดังตัวอย่าง
ด้านธรณีวิทยา ใช้C-14 ซึ่งมีครึ่งชีวิต 5730 ปีหาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ ประกอบ เช่น ไม้กระดูก สารอินทรีย์ต่าง ๆ การหาอายุวัตถุโบราณโดยการวัดปริมาณของ C-14 อธิบายได้ว่า ในบรรยากาศมี C-14 ซึ่งเกิดจากไนโตรเจนรวมตัวกับนิวตรอนจากรังสีคอสมิก ดังปฏิกิริยา
ในอากาศจึงมีทั้งคาร์บอนในรูปของ C-12 และ C-14 เมื่อคาร์บอนทำ ปฏิกิริยากับออกซิเจนใน อากาศเกิดเป็นแก๊สคาร์บอนไดออกไซด์จึงพบทั้งในรูปของ ¹²CO₂ ปนอยู่กับ ¹⁴CO₂ ซึ่งพืชจะนำ ไปใช้ในกระบวนการสังเคราะห์ด้วยแสง เมื่อสัตว์กินพืชเหล่านั้นเป็นอาหาร C-14 จะเข้าสู่ร่างกาย ของสัตว์ทำ ให้พบ C-14 ได้ทั้งในพืชและสัตว์ ขณะที่พืชหรือสัตว์ยังมีชีวิตอยู่ ¹⁴CO₂ จะถูกรับเข้า และขับออกตลอดเวลา เป็นผลให้C-14 ในสิ่งมีชีวิตมีความเข้มข้นคงที่หรือกล่าวว่าสัดส่วนระหว่าง C-14 ต่อ C-12 มีค่าคงที่ เมื่อสิ่งมีชีวิตตาย การรับ C-14 เข้าสู่ร่างกายจะสิ้นสุดลง แต่การสลายตัวยัง เกิดขึ้นต่อไป จึงทำ ให้มีปริมาณ C-14 หรือสัดส่วนระหว่าง C–14 ต่อ C–12 ลดลงเรื่อย ๆ ดังนั้นถ้า ทราบสัดส่วนระหว่าง C-14 ต่อ C-12 ในขณะที่ยังมีชีวิตอยู่และวัดปริมาณของ C–14 ในขณะที่นำ มาศึกษาได้ก็สามารถทำ นายอายุได้ เช่น สมมติว่าพบซากไม้โบราณชิ้นหนึ่งมีอัตราการสลายตัวของ C–14 ลดลงไปครึ่งหนึ่งจากของเดิมขณะที่ยังมีชีวิตอยู่ก็อาจสรุปได้ว่า ไม้ชิ้นนั้นตายมาแล้วเท่ากับ ครึ่งชีวิตของ C–14 หรือมีอายุประมาณ 5730 ปี
ด้านการแพทย์ ใช้เพื่อศึกษาความผิดปกติของอวัยวะต่าง ๆ ในร่างกาย โดยให้คนไข้รับประทาน อาหารหรือยาที่มีไอโซโทปกัมมันตรังสีจำ นวนเล็กน้อย จากนั้นใช้เครื่องมือตรวจสอบรังสีเพื่อติดตาม ดูผลการดูดซึมไอโซโทปกัมมันตรังสีของระบบอวัยวะต่าง ๆ เช่น ให้ดื่มสารละลาย I–131 แล้ว ติดตามดูความผิดปกติของต่อมไทรอยด์ ใช้I–132 ติดตามดูภาพสมอง ฉีด Na–24 เข้าเส้นเลือด โดยตรงเพื่อดูระบบการไหลเวียนของเลือด รับประทาน Tc–99 เมื่อต้องการดูภาพหัวใจ ตับ ปอด นอกจากนี้แพทย์ยังใช้ไอโซโทปกัมมันตรังสีรักษาโรคโดยตรง เช่น ใช้Co–60 หรือ Ra–226 ในการ รักษาโรคมะเร็ง
ด้านเกษตรกรรม ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืช โดย เริ่มต้นจากการดูดซึมที่รากจนถึงการคายออกที่ใบ หรือจำ นวนแร่ธาตุที่พืชสะสมไว้ที่ใบ เช่น ใช้P–32 จำ นวนเล็กน้อยผสมกับฟอสฟอรัสที่ไม่มีรังสีเพื่อทำ ปุ๋ย แล้วใช้เครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์ ตรวจวัดรังสีที่ใบของพืช ใช้รังสีเพื่อการปรับปรุงเมล็ดพันธุ์พืชให้ได้พันธุกรรมตามต้องการโดยการนำ เมล็ดพันธุ์พืชมาอาบรังสีนิวตรอนในปริมาณและระยะเวลาที่เหมาะสมจะทำ ให้เกิดการกลายพันธุ์ได้
ด้านอุตสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่าง เช่น ใช้ตรวจหารอยตำ หนิใน โลหะหรือรอยรั่วของท่อขนส่งของเหลว โดยผสมไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไป ตามท่อ แล้วติดตามการแผ่รังสีด้วยเครื่องไกเกอร์มึลเลอร์เคาน์เตอร์ถ้าบริเวณใดที่เครื่องมีสัญญาณ จำ นวนนับมากผิดปกติแสดงว่าบริเวณนั้นมีการรั่วไหลเกิดขึ้น ใช้วัดความหนาของวัตถุเนื่องจากรังสี แต่ละชนิดทะลุทะลวงวัตถุได้ดีไม่เท่ากัน ดังนั้นเมื่อผ่านรังสีไปยังแผ่นวัตถุต่าง ๆ เช่น โลหะ กระดาษ พลาสติก แล้ววัดความสามารถในการดูดซับรังสีของวัตถุนั้นด้วยเครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์ เปรียบเทียบจำ นวนนับกับตารางข้อมูลก็จะทำ ให้ทราบความหนาของวัตถุได้
ในอุตสาหกรรมการทำ อัญมณีใช้รังสีเพื่อทำ ให้อัญมณีมีสีสันสวยงามขึ้น โดยใช้รังสีแกมมา นิวตรอน หรืออิเล็กตรอนพลังงานสูงฉายไปบนอัญมณี จะทำ ให้สารที่ทำ ให้เกิดสีบนอัญมณีเปลี่ยนสี ไปได้ อัญมณีที่ฉายด้วยรังสีแกมมาจะไม่มีรังสีตกค้างแต่การอาบด้วยรังสีนิวตรอนจะมีไอโซโทป กัมมันตรังสีเกิดขึ้น จึงต้องปล่อยให้ไอโซโทปกัมมันตรังสีสลายตัวจนมีระดับรังสีที่ปลอดภัยจึงนำ มาใช้ประโยชน์
การเก็บถนอมอาหาร ใช้ Co–60 ซึ่งจะให้รังสีแกมมาที่ไม่มีผลตกค้างและรังสีจะทำ ลาย แบคทีเรีย จึงช่วยเก็บรักษาอาหารไว้ได้นานหลายวันหลังจากการผ่านรังสีเข้าไปในอาหารแล้ว
จะเห็นได้ว่าไอโซโทปกัมมันตรังสีให้ประโยชน์ต่อมนุษย์อย่างมาก แต่ถ้าใช้ในปริมาณไม่ถูกต้อง หรือนำไปใช้ในสภาพไม่เหมาะสมก็จะมีผลต่อสิ่งมีชีวิตและสิ่งแวดล้อมได้




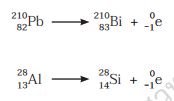










ไม่มีความคิดเห็น:
แสดงความคิดเห็น