2.1.1 แบบจำลองอะตอมของดอลตัน
ในปี พ.ศ. 2346 จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎี อะตอม เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงมวลของสารก่อนและหลังทำปฏิกิริยาเคมี รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่ง ๆ ซึ่งมีสาระสำคัญดังนี้ 1. ธาตุประกอบด้วยอนุภาคเล็ก ๆ อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้ สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน เช่น มีมวลเท่ากัน แต่จะมีสมบัติแตกต่าง จากอะตอมของธาตุอื่น 3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็น เลขลงตัวน้อย ๆ
 |
| รูป 2.1 แบบจำลองอะตอมตามทฤษฎีของดอลตัน |
สมบัติของอะตอมได้เพียงระดับหนึ่ง ต่อมาได้มีการศึกษาเกี่ยวกับอะตอมเพิ่มขึ้น และค้นพบว่ามีข้อมูล
บางประการไม่สอดคล้องกับแนวคิดของดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันมีมวลแตกต่าง
กันได้ อะตอมสามารถแบ่งแยกได้ แนวคิดเกี่ยวกับทฤษฎีอะตอมของดอลตันจึงไม่ถูกต้อง
2.1.2 แบบจำลองอะตอมของทอมสัน
นักวิทยาศาสตร์หลายคนได้ศึกษาการนำไฟฟ้าของแก๊ส โดยทดลองเกี่ยวกับผลของการใช้ ความต่างศักย์ไฟฟ้าสูงต่อการเคลื่อนที่ของประจุไฟฟ้าของอะตอมแก๊ส เพื่อให้ได้ข้อมูลที่ให้รายละเอียดเกี่ยวกับโครงสร้างภายในอะตอม โดยการผ่านไฟฟ้ากระแสตรงเข้าไปในหลอดแก้วบรรจุแก๊สความดันต่ำ (ดูดอากาศออก) ซึ่งที่ภาวะนี้มีจำนวนอะตอมของแก๊สไม่หนาแน่น ประจุไฟฟ้าสามารถเดินทางได้ไกลและพบว่าเมื่อเพิ่มความต่างศักย์ระหว่างขั้วไฟฟ้าให้สูงขึ้นจะมีกระแสไฟฟ้าไหลผ่านตลอด ขณะเดียวกันจะมีรังสีออกจากแคโทดไปยังแอโนด รังสีนี้เรียกว่า รังสีแคโทด (cathode ray) เรียกหลอดแก้วชนิดนี้ว่า หลอดรังสีแคโทด (cathode ray tube) เนื่องจากมนุษย์ไม่สามารถมองเห็นรังสีแคโทดด้วยตาเปล่าได้ ดังนั้น เพื่อให้สามารถติดตามทิศทางการเคลื่อนที่ของรังสีแคโทดได้ จึงต้องฉาบสารเรืองแสง เช่น ซิงค์ซัลไฟด์ ฟอสฟอรัส ไว้ที่ฉาก เมื่อรังสีแคโทดตกกระทบที่ฉากจะปรากฏเป็นจุดเรืองแสงที่สามารถสังเกตเห็นด้วยตาเปล่าได้ นักวิทยาศาสตร์ได้ทำการทดลองเพื่อศึกษาการเคลื่อนที่ของรังสีแคโทดโดยให้เคลื่อนที่ผ่าน สนามไฟฟ้าดังรูป 2.2 ก) พบว่าแนวการเคลื่อนที่เบนไปจากเดิม โดยเบนเข้าหาขั้วบวกของสนามไฟฟ้า เนื่องจากรังสีแคโทดเบนเข้าหาขั้วบวกของสนามไฟฟ้าจึงสรุปว่ารังสีแคโทดประกอบด้วยอนุภาคที่มี ประจุไฟฟ้าลบ เมื่อศึกษาเพิ่มเติมโดยให้รังสีแคโทดเคลื่อนที่ผ่านสนามแม่เหล็กดังรูป 2.2 ข) พบว่า แนวการเคลื่อนที่เบนไปจากเดิมเช่นกัน
 |
| รูป 2.2 |
ในช่วงปี พ.ศ. 2440 โจเซฟ จอห์น ทอมสัน (Joseph John Thomson) นักวิทยาศาสตร์ชาวอังกฤษ
ทำการทดลองโดยให้รังสีแคโทดเคลื่อนที่ผ่านสนามไฟฟ้าที่ตั้งฉากกับสนามแม่เหล็ก และปรับขนาด
ของสนามไฟฟ้าให้พอเหมาะจนกระทั่งทิศทางการเคลื่อนที่ของรังสีแคโทดไม่เบนไปจากแนวเดิม ดังรูป
2.2 ค) ซึ่งสภาวะนี้แรงที่เกิดขึ้นจากสนามไฟฟ้าและสนามแม่เหล็กมีขนาดเท่ากันแต่มีทิศตรงข้ามกัน
จากข้อมูลการทดลองร่วมกับทฤษฎีทางแม่เหล็กไฟฟ้าทำให้ทอมสันนำมาใช้คำนวณอัตราส่วนของ
ประจุต่อมวล (e/m) ของรังสีแคโทดได้ ทอมสันได้ทดลองเพื่อศึกษาอัตราส่วนของประจุต่อมวล
ของรังสีแคโทดซ้ำหลายครั้งโดยเปลี่ยนชนิดของแก๊สและชนิดของโลหะที่ใช้ทำขั้ว แคโทดปรากฏว่า
อัตราส่วนของประจุต่อมวลของรังสีแคโทดมีค่าโดยประมาณเท่ากันคือ 1.76 × 10⁸ คูลอมบ์ต่อกรัม
(C/g) จึงสรุปว่าอนุภาครังสีแคโทดที่ออกมาจากโลหะต่างชนิดเป็นอนุภาคชนิดเดียวกัน ซึ่งต่อมาได้
เรียกอนุภาคนี้ว่า อิเล็กตรอน (electron)
การค้นพบอิเล็กตรอนทำให้ทอมสันสรุปได้ว่า อะตอมทุกชนิดมีอิเล็กตรอนเป็นองค์ประกอบ ซึ่งลบล้างแนวคิดที่ว่าอะตอมแบ่งแยกไม่ได้ และเนื่องจากสารต่าง ๆ ที่อยู่ในสภาวะปกติจะเป็นกลางทางไฟฟ้า นักวิทยาศาสตร์จึงสรุปว่า อะตอมเป็นกลางทางไฟฟ้า ซึ่งจากข้อมูลดังกล่าวทำให้ทอมสันเสนอแบบจำลองของอะตอมว่า อะตอมเป็นรูปทรงกลมประกอบด้วยเนื้ออะตอมซึ่งมีประจุบวกและอิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่วไป ดังรูป 2.3 อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
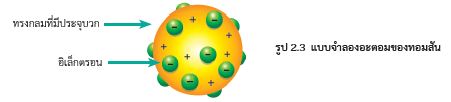 |
| รูป 2.3 |
ทอมสันเป็นนักวิทยาศาสตร์คนแรกที่เสนอรายละเอียดภายในอะตอม ทำให้มโนภาพของอะตอมชัดเจนขึ้น อย่างไรก็ตามในช่วงเวลาต่อมานักวิทยาศาสตร์ได้ทำการทดลองเพิ่มเติมและมีข้อมูลเพิ่มขึ้น ซึ่งแบบจำลองอะตอมของทอมสันไม่สามารถอธิบายได้
2.1.3 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
เมื่อปี พ.ศ. 2454 เออร์เนสต์ รัทเทอร์ฟอร์ด (Ernest Rutherford) นักวิทยาศาสตร์ชาวอังกฤษ
และ ฮันส์ ไกเกอร์ (Hans Geiger) นักวิทยาศาสตร์ชาวเยอรมัน ได้พิสูจน์แบบจำลองอะตอมของ
ทอมสันโดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ
รัทเทอร์ฟอร์ดอธิบายลักษณะภายในอะตอมว่า การที่รังสีแอลฟาส่วนใหญผ่านแผ่น ทองคำ ไปได้
แสดงว่า ภายในอะตอมต้องมีที่ว่างอยู่เป็นบริเวณกว้าง การที่รังสีแอลฟาบางอนุภาคเบี่ยงเบนหรือสะท้อนกลับมาบริเวณด้านหน้าของฉากเรืองแสง แสดงว่าภายในอะตอมน่าจะมีกลุ่มอนุภาคที่มีขนาดเล็กมาก มีมวลสูงมากกว่ารังสีแอลฟาและมีประจุบวก รัทเทอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมใหม่ว่า อะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กมากอยู่ภายในและมีประจุไฟฟ้าเป็นบวก โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบ ๆ ดังรูป 2.4
 |
| รูป 2.4 |
ตามแบบจำลองของรัทเทอร์ฟอร์ด ภายในอะตอมมีนิวเคลียสซึ่งมีขนาดเล็กมาก เมื่อเทียบกับ
ขนาดของอะตอม รังสีแอลฟาจึงมีโอกาสชนนิวเคลียสได้น้อยมาก ส่วนอิเล็กตรอนที่อยู่รอบนิวเคลียส
มีมวลน้อยมาก การชนกับอิเล็กตรอนจึงไม่มีผลทำให้ทิศทางการเคลื่อนที่ของรังสีแอลฟาเปลี่ยนไป
รังสีส่วนใหญ่จึงทะลุแผ่นทองคำไปเป็นแนวตรง มีบางครั้งที่รังสีแอลฟาวิ่งเฉียดนิวเคลียส ซึ่งจะถูก
ประจุของนิวเคลียสผลักให้เบนไปจากแนวเส้นตรง ส่วนรังสีแอลฟาที่วิ่งตรงไปยังนิวเคลียสซึ่งมีมวล
มากก็จะถูกผลักให้สะท้อนกลับ ดังแสดงในรูป 2.5
 |
| รูป 2.5 การใช้แบบจำลองอธิบายผลการทดลองของรัทเทอร์ฟอร์ด |
ตามแนวคิดของรัทเทอร์ฟอร์ดจะพบว่ามวลส่วนใหญ่ของอะตอมคือมวลของนิวเคลียส ส่วน
อิเล็กตรอนถึงแม้จะเป็นส่วนประกอบที่ทำให้อะตอมมีขนาดใหญ่แต่มีมวลน้อยมากจนถือว่าไม่มีผล
ต่อมวลของอะตอม
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด ไม่ได้อธิบายว่าอิเล็กตรอนอยู่รอบนิวเคลียสในลักษณะใด
นักวิทยาศาสตร์จึง ได้ทำการทดลองเพื่อ รวบรวมข้อมลูเพิ่มเติมเกี่ยวกับตำแหน่งของอิเล็กตรอนเพื่อ นำ
มาสร้างเป็นแบบจำลองที่มีความสมบูรณ์มากยิ่งขึ้น
2.1.4. แบบจำลองอะตอมของโบร์
สเปกตรัมแม่เหล็กไฟฟ้าประกอบด้วยคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นต่าง ๆ กัน และมี
ความถี่ต่อเนื่องกันเป็นช่วงกว้าง มีทั้งที่มองเห็นได้และมองไม่เห็น มีชื่อเรียกต่าง ๆ กัน แสงที่ประสาท
ตาของมนุษย์สามารถรับรู้ได้เรียกว่า แสงที่มองเห็นได้ (visible light) มีความยาวคลื่นอยู่ในช่วง
400–700 นาโนเมตร ซึ่งประกอบด้วยแสงสีต่าง ๆ กัน แต่ประสาทตาของมนุษย์ไม่สามารถแยกแสง
ที่มองเห็นเป็นสีต่าง ๆ ได้เอง ทำให้มองเห็นสีรวมกัน ซึ่งเรียกว่า แสงขาว (white light) และเมื่อให้
แสงขาวส่องผ่านปริซึม แสงขาวจะแยกออกเป็นแสงสีรุ้งต่อเนื่องกัน เรียกว่า แถบสเปกตรัมของแสง
ขาว ดังรูป 2.6
 |
| รูป 2.6 |
มักซ์ พลังค์ (Max Planck) นักวิทยาศาสตร์ชาวเยอรมัน ได้ศึกษาพลังงานของคลื่นแม่เหล็กไฟฟ้าและได้ข้อสรุปเกี่ยวกับความสัมพันธ์ระหว่างพลังงานของคลื่นแม่เหล็กไฟฟ้ากับความถี่ของคลื่นนั้นว่า พลังงานของคลื่นแม่เหล็กไฟฟ้าแปรผันตามความถี่ของคลื่นและแปรผกผันกับความยาวคลื่น ดังความ สัมพันธ์ต่อไปนี้
เมื่อ
E คือพลังงานของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็น จูล
h คือค่าคงตัวของพลังค์ มีค่า 6.626 × 10^-34 จูลวินาที
ν คือความถี่ของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นเฮิรตซ์
c คือความเร็วของคลื่นแม่เหล็กไฟฟ้าในสุญญากาศ ซึ่งเท่ากับ 2.997 × 10^8 เมตรต่อวินาที(อาจใช้3.0 × 10^8 เมตรต่อวินาที)
และ λ คือความยาวคลื่นของคลื่นแม่เหล็กไฟฟ้า หน่วยเป็นเมตร
ความสัมพันธ์ดังกล่าวนี้เมื่อนำ มาคำ นวณพลังงานของแถบสีต่าง ๆ ในสเปกตรัมของแสงขาว ซึ่งมีความยาวคลื่นต่าง ๆ จะได้ดังนี้
 |
| รูป 2.7 แถบสเปกตรัมของแสงขาวและเส้นสเปกตรัมของธาตุบางชนิด |
ธาตุต่าง ๆ เมื่อได้รับพลังงานจะเปล่งแสงเป็นสีต่าง ๆ หลายสีเมื่อสีเหล่านั้นรวมกันแล้วจะ สังเกตเห็นเป็นสีเดียวซึ่งตาเราไม่สามารถบอกความแตกต่างได้ แต่เมื่อใช้แผ่นเกรตติงส่องดูจะเห็น เส้นสเปกตรัมของแต่ละธาตุที่มีลักษณะเฉพาะ เช่น จำ นวนเส้น สีหรือตำ แหน่งที่เกิดต่างกันไป การเกิด เส้นสเปกตรัมของธาตุอธิบายได้ว่า อิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบนิวเคลียสมีพลังงานเฉพาะตัว ที่ต่ำ หรือกล่าวได้ว่าอะตอมอยู่ใน สถานะพื้น (ground state) เมื่ออะตอมได้รับพลังงานเพิ่มขึ้นทำ ให้ อิเล็กตรอนถูกกระตุ้นให้มีพลังงานสูงขึ้นหรือเรียกว่าอะตอมอยู่ใน สถานะกระตุ้น (excited state) ที่สถานะนี้อะตอมจะไม่เสถียร เนื่องจากมีพลังงานสูง อิเล็กตรอนจึงคายพลังงานออกมาส่วนหนึ่ง ทำ ให้อะตอมมีพลังงานลดลงแล้วกลับเข้าสู่สถานะที่มีพลังงานต่ำ ลงเพื่อให้อะตอมมีความเสถียร มากขึ้น พลังงานส่วนใหญ่ที่คายออกมาจะปรากฏในรูปพลังงานแสง และสามารถคำ นวณได้โดย ใช้ความสัมพันธ์ตามสมการของพลังค์ซึ่งได้กล่าวไว้แล้วในข้างต้น ถ้าแสงสีเหล่านี้แยกออกจากกัน อย่างชัดเจนจะปรากฏเป็นเส้นสเปกตรัม แต่ถ้าแสงสีที่ปรากฏออกมามีลักษณะต่อเนื่องกันเช่นเดียว กับรุ้งหรือจากไส้หลอดไฟฟ้าซึ่งเป็นโลหะร้อนและมีอะตอมอยู่กันอย่างหนาแน่น จะให้สเปกตรัมเป็น แถบสเปกตรัมซึ่งยากแก่การวิเคราะห์และแปลผล สภาวะของอิเล็กตรอนที่มีพลังงานต่าง ๆ เรียกว่า ระดับพลังงานของอิเล็กตรอน (energy level of electron)
จากการศึกษาเส้นสเปกตรัมของอะตอมไฮโดรเจนซึ่งมี1 อิเล็กตรอน พบว่ามีเส้นสเปกตรัม ปรากฏในช่วงคลื่นที่มองเห็นได้โดยมีความยาวคลื่น 410 434 486 และ 656 นาโนเมตร ตามลำ ดับ เมื่อคำ นวณผลต่างระหว่างพลังงานของเส้นสเปกตรัมที่อยู่ถัดกัน จะได้ข้อมูลดังตาราง 2.2
จากข้อมูลในตาราง 2.2 แสดงว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับโดยความแตกต่าง ระหว่างพลังงานแต่ละระดับที่อยู่ถัดไปมีค่าไม่เท่ากันและความแตกต่างของพลังงานมีค่าน้อยลงเมื่อ ระดับพลังงานสูงขึ้น
การที่นักวิทยาศาสตร์ใช้อะตอมของไฮโดรเจนเป็นตัวอย่างในการแปลความหมายของเส้นสเปกตรัม เพราะอะตอมของไฮโดรเจนมีอิเล็กตรอนเดียว จากการทดลองหลายครั้งพบว่า อะตอมของไฮโดรเจนให้ เส้นสเปกตรัมได้หลายเส้นที่มีลักษณะเหมือนกันทุกครั้ง จึงสรุปได้ว่าอิเล็กตรอนในอะตอมของไฮโดรเจน ขึ้นไปอยู่ในสถานะกระตุ้นที่มีพลังงานแตกต่างกันได้หลายระดับ ค่าพลังงานของเส้นสเปกตรัมแสดงให้เห็น ถึงการเปลี่ยนระดับพลังงานของอิเล็กตรอนในอะตอมจากระดับพลังงานสูงมายังระดับพลังงานต่ำ ดังรูป 2.8
 |
| รูป 2.8 การเปลี่ยนระดับพลังงานของอิเล็กตรอนในอะตอมของไฮโดรเจน |
การเปลี่ยนแปลงพลังงานของอิเล็กตรอนระหว่างสถานะกระตุ้นและสถานะพื้นสามารถ อุปมานได้กับการกลิ้งลงขั้นบันไดของลูกบอล ดังรูป 2.9
 |
| รูป 2.9 |
จากรูปจะเห็นว่าพลังงานศักย์ณ บันไดแต่ละขั้นมีค่าไม่เท่ากัน โดยลูกบอลที่อยู่บันไดขั้นต่ำ จะมีพลังงานศักย์ต่ำ กว่าบันไดขั้นสูง และผลต่างของพลังงานระหว่างบันไดสองขั้นมีค่าเฉพาะตัว ที่แน่นอน โดยขั้นบันไดที่อยู่ห่างกันมากจะมีผลต่างของพลังงานมากกว่าขั้นบันไดที่อยู่ติดกัน เช่น ผลต่างของพลังงานระหว่างขั้นที่ 1 กับขั้นที่ 3 จะมีค่ามากกว่าขั้นที่ 1 กับขั้นที่ 2 หรืออาจสรุปได้ว่า ผลต่างของพลังงานศักย์ระหว่างขั้นบันไดขึ้นอยู่กับความแตกต่างระหว่างความสูงของขั้นบันไดและ มีค่าเฉพาะตัว การกลิ้งลงขั้นบันไดของลูกบอล ลูกจะต้องกลิ้งลงและหยุดที่ขั้นบันไดเท่านั้น ลูกบอล ไม่สามารถหยุดระหว่างขั้นบันไดได้เนื่องจากไม่มีที่พักระหว่างขั้นบันได ลูกบอลอาจกลิ้งและหยุดบน ขั้นบันไดขั้นที่ติดกันหรือขั้นที่อยู่ห่างออกไปได้เช่น จากขั้นที่ 5 ลงมายังขั้นที่ 4 หรือจากขั้นที่ 3 ลง มาขั้นที่ 1
จากการศึกษาเส้นสเปกตรัมของอะตอมไฮโดรเจนทำ ให้นักวิทยาศาสตร์สรุปได้ว่า
1. เมื่ออิเล็กตรอนได้รับพลังงานในปริมาณที่เหมาะสม อิเล็กตรอนจะขึ้นไปอยู่ในระดับพลังงาน ที่สูงกว่าระดับพลังงานเดิม แต่จะอยู่ในระดับใดขึ้นกับปริมาณพลังงานที่ได้รับ การที่อิเล็กตรอน ขึ้นไปอยู่ในระดับพลังงานใหม่ทำ ให้อะตอมไม่เสถียร อิเล็กตรอนจะกลับมาอยู่ในระดับพลังงานที่ต่ำ กว่า ซึ่งการเปลี่ยนตำ แหน่งของแต่ละระดับพลังงานนี้ อิเล็กตรอนจะคายพลังงานออกมาในรูปของ คลื่นแม่เหล็กไฟฟ้าด้วยความถี่เฉพาะค่าหนึ่งหรือกล่าวได้ว่าการดูดหรือคายพลังงานของอิเล็กตรอน ในอะตอมต้องมีค่าเฉพาะตามทฤษฎีของพลังค์โดยมีค่าเท่ากับความถี่ของคลื่นแม่เหล็กไฟฟ้านั้นคูณ ด้วยค่าคงที่ของพลังค์ดังที่กล่าวมาแล้ว
2. การเปลี่ยนระดับพลังงานของอิเล็กตรอนไม่จำ เป็นต้องเปลี่ยนไปยังระดับพลังงานที่อยู่ติดกัน อาจมีการเปลี่ยนข้ามระดับพลังงานได้และจะอยู่ระหว่างระดับพลังงานไม่ได้
3. ผลต่างระหว่างพลังงานของระดับพลังงานต่ำ จะมีค่ามากกว่าผลต่างระหว่างพลังงานของ ระดับพลังงานที่สูงขึ้นไป
จากความรู้เรื่องการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนและการเกิดสเปกตรัม ช่วยให้ นีลส์ โบร์ (Niels Bohr) นักวิทยาศาสตร์ชาวเดนมาร์ก สร้างแบบจำ ลองอะตอมเพื่อใช้อธิบาย พฤติกรรมของอิเล็กตรอนในอะตอมได้ โดยกล่าวว่า อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็น วงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว ระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุดมีพลังงานต่ำ ที่สุดเรียกว่าระดับ K และระดับพลังงานที่อยู่ถัดออกมาเรียกเป็น L M N … ตามลำดับ ดังรูป 2.10
 |
| รูป 2.10 แบบจำลองอะตอมของโบร์ที่แสดงระดับพลังงานของอิเล็กตรอน |
n = 3 4 … หมายถึงระดับ พลังงานที่ 3 4 และสูงขึ้นไปตามลำดับ
2.1.5 แบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองอะตอมของโบร์มีข้อจำกัดคือไม่สามารถใช้อธิบายสเปกตรัมของอะตอมที่มีหลาย อิเล็กตรอนได้นักวิทยาศาสตร์จึงได้ศึกษาเพิ่มเติมจนได้ข้อมูลเพียงพอที่จะเชื่อว่าอิเล็กตรอนมีสมบัติ เป็นทั้งอนุภาคและคลื่นโดยเคลื่อนที่รอบนิวเคลียส บริเวณที่พบอิเล็กตรอนมีหลายลักษณะเป็นรูปทรง ต่าง ๆ ตามระดับพลังงานของอิเล็กตรอน จากการประยุกต์ใช้สมการทางคณิตศาสตร์และใช้คอมพิวเตอร์ ช่วยในการคำ นวณ เพื่อหาโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่าง ๆ พบว่าสามารถอธิบาย เส้นสเปกตรัมของธาตุได้ถูกต้องกว่าแบบจำลองอะตอมของโบร์และสามารถอธิบายได้ว่าอิเล็กตรอน มีขนาดเล็กมากและเคลื่อนที่อย่างรวดเร็วตลอดเวลาไปทั่วทั้งอะตอม จึงไม่สามารถบอกตำแหน่งที่แน่นอน ของอิเล็กตรอนได้ อย่างไรก็ตามนักวิทยาศาสตร์พบว่ามีโอกาสที่จะพบอิเล็กตรอนรอบนิวเคลียส บางบริเวณเท่านั้น ทำ ให้สร้างมโนภาพได้ว่าอะตอมประกอบด้วยกลุ่มหมอกอิเล็กตรอน (electron cloud) รอบนิวเคลียส บริเวณที่กลุ่มหมอกทึบแสดงว่ามีโอกาสที่จะพบอิเล็กตรอนได้มากกว่าบริเวณ ที่มีกลุ่มหมอกจาง เรียกแบบจำลองนี้ว่าแบบจำลองอะตอมแบบกลุ่มหมอก (electron cloud model of atom) ดังรูป 2.11 (แต่ละจุดคือ 1 โอกาสที่จะพบอิเล็กตรอน)
 |
| รูป 2.11 ภาพ 2 มิติแสดงกลุ่มหมอกอิเล็กตรอนของไฮโดรเจนอะตอมซึ่งมี 1 อิเล็กตรอน |
แบบจำลองอะตอมแบบกลุ่มหมอกที่แสดงถึงความหนาแน่นของอิเล็กตรอนรอบนิวเคลียส ทำได้ยาก โดยทั่วไปจึงพิจารณาอะตอมในลักษณะทรงกลม เช่น ลูกปิงปอง หรือพลาสติกทรงกลม เป็นแบบจำลองแทนอะตอมของธาตุ แต่นักเรียนควรระลึกไว้เสมอว่าการใช้แบบจำ ลองเช่นนี้เพียง เพื่อช่วยให้คิดตามได้ง่ายขึ้นเท่านั้น เมื่อนักเรียนได้ศึกษาในระดับที่สูงขึ้นไปจะพบว่ารูปทรงของกลุ่ม หมอกอิเล็กตรอนไม่ได้มีเพียงรูปทรงกลมเท่านั้น
โครงสร้างอะตอมตามแบบจำลองอะตอมแบบกลุ่มหมอกยังไม่ใช่ข้อยุติในการศึกษาทดลองเกี่ยวกับอะตอม เพราะความรู้ทางวิทยาศาสตร์มีการพัฒนาอย่างต่อเนื่องตลอดเวลา ดังนั้นในอนาคตจึงอาจมีแบบจำลองอะตอมแบบอื่นตามข้อมูลที่ค้นพบใหม่




ไม่มีความคิดเห็น:
แสดงความคิดเห็น